大家好,今天小编关注到一个比较有意思的话题,就是关于碘钟反应的问题,于是小编就整理了4个相关介绍碘钟反应的解答,让我们一起看看吧。
碘钟反应原理是什么,方程式是什么?
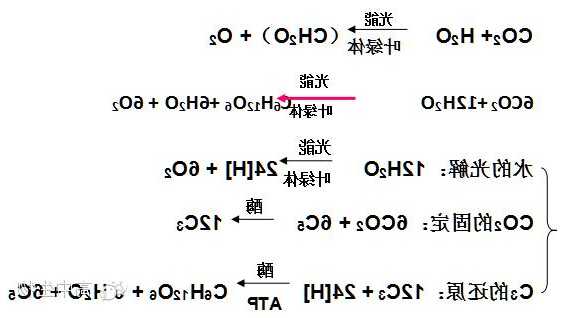
过氧化氢型碘钟
向硫酸酸化的过氧化氢溶液中加入碘酸钾、硫代硫酸钠和淀粉的混合溶液。此时在体系中存在两个主要反应,化学方程式为:
H2O2(aq)+3I-(aq)+2H+→I3-+2H2O
I3-(aq)+2S2O32?(aq)→3I-(aq)+S4O62-(aq)
碘酸盐型碘钟
向用硫酸酸化的碘酸盐中加入亚硫酸氢钠(以及少量淀粉溶液),此时体系中出现如下反应:
IO3-(aq)+3HSO3-(aq)→I-(aq)+3HSO4-(aq)
然后过量的碘酸根离子与碘离子发生归中反应:
IO3-(aq)+5I-(aq)+6H+(aq)→3I2+3H2O(l)
接着亚硫酸氢钠将生成的碘还原:
I2(aq)+HSO3-(aq)+H2O(l)→2I-(aq)+HSO4-(aq)+2H+(aq)
过硫酸盐型碘钟
通过过硫酸钾、过硫酸钠或过硫酸铵将碘离子氧化成碘单质。加入硫代硫酸钠可以将碘单质还原回碘离子。化学方程式如下:
2I-(aq)+S2O82-(aq)→I2(aq)+2SO42-(aq)
I2(aq)+2S2O32-(aq)→2I-(aq)+S4O62-(aq)
氯酸盐型碘钟
将碘液、氯酸钠和高氯酸混合,化学方程式如下:
I3-→I-+I2
ClO3-+I-+2H+→HIO+HClO2
ClO3-+HIO+H+→HIO2+HClO2
ClO3-+HIO2→IO3-+HClO2
碘钟反应最终结束生成什么?
过氧化氢型碘钟向硫酸酸化的过氧化氢溶液中加入碘酸钾、硫代硫酸钠和淀粉的混合溶液。
此时在体系中存在两个主要反应,化学方程式为:H2O2+3I−+2H+→ I3−+2H2OI3−+2S2O32− → 3I−(aq)+S4O62−(aq)1,除了H2O2消耗外,H+离子也在消耗的!
2,锰离子是作为催化剂。这个反应的主要原理是:首先过碘酸钾在锰离子催化下氧化过氧化氢,得到的碘与淀粉成蓝色。碘离子浓度高了之后,就会被过氧化氢氧化为碘酸钾,蓝色消失。
丙二酸的作用是与碘单质反应生成碘代丙二酸放出碘离子,从而与碘单质反应生成I3-离子增大碘的溶解度。3,个人理解:不是不立即反应回去一点,而是由于没有再次混匀,接触不到其他的离子,所以,反应不能继续下去,如果是在持续震荡中,就没有这个碘钟反应了!
碘钟震荡反应的原理?
碘钟反应是一种化学振荡反应,其体现了化学动力学的原理。 它于1886年被瑞士化学家Hans Heinrich Landolt发现。 在碘钟反应中,两种(或三种)无色的液体被混合在一起,并在几秒钟后变成靛蓝色。
碘酸根被硫代硫酸钠还原是一个很吸引人的反应,常常被用来作为说明反应速率的实验典范。
如事先同时加入少量硫代硫酸钠标准溶液和淀粉指示剂,则产生的碘便很快被还原为碘离子,直到S₂O₃消耗完,游离碘遇上淀粉即显示蓝色。
从反应开始到蓝色出现所经历的时间,即可作为反应初速的计量。 由于这一反应能自身显示反应进程,故常称为“碘钟”反应。
碘钟的原理?
碘钟是一种使用化学反应原理的计时器,其原理基于碘与亚铁离子之间的氧化还原反应。当开始计时时,溶液中的碘和亚铁离子反应生成蓝色的三碘化物离子,随着反应的进行,溶液的颜色由深蓝逐渐变为无色。通过测量溶液颜色的变化,可以确定反应进行的时间,从而实现计时的功能。碘钟以其简单、可靠的原理和操作方式,广泛用于实验室和教学中,为化学实验和观测提供了精确的计时工具。
到此,以上就是小编对于碘钟反应的问题就介绍到这了,希望介绍关于碘钟反应的4点解答对大家有用。
本文转载自互联网,如有侵权,联系删除