大家好,今天小编关注到一个比较有意思的话题,就是关于电解饱和食盐水的问题,于是小编就整理了5个相关介绍电解饱和食盐水的解答,让我们一起看看吧。
电解饱和食盐水方程和阴阳反应式?
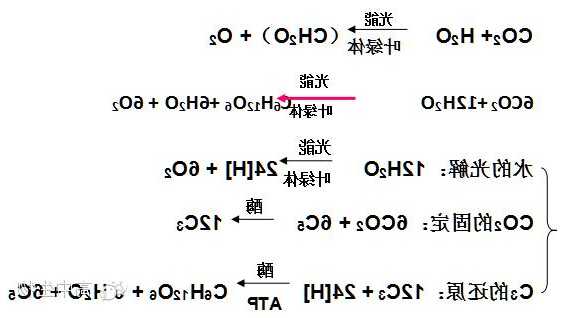
正极:(2Cl- ) - ( 2e-)= Cl2
负极:2H2O + (2e-) = H2 + (2OH-)
总离子式:通电
2Cl- + 2H2O======= H2 + Cl2 + 2OH
总化学式:电解
2NaCl+2H2O==Cl2(气体)+H2(气体)+2NaOH
水和盐电解会产生什么?
在食盐水里氯化钠完全电离,水分子是微弱电离的,因而存在着Na+、H+、Cl-、OH-四种离子。
NaCl=Na++Cl-
H2O =H++OH-
当接通直流电源后,带负电的OH-和Cl-移向阳极,带正电的Na+和H+移向阴极。
在这样的电解条件下,在阳极,Cl-比OH-容易失去电子被氧化成氯原子,氯原子两两结合成氯分子放出氯气。
2Cl--2e=Cl2↑(氧化反应)
在阴极,H+比Na+容易得到电子,因而H+不断从阴极获得电子被还原为氢原子,氢原子两两结合成氢分子从阴极放出氢气。
2H++2e=H2↑ (还原反应)
由于H+在阴极上不断得到电子而生成氢气放出,破坏了附近的水的电离平衡,水分子继续电离成H+和OH-,H+又不断得到电子,结果溶液里OH-的数目相对地增多了。因而阴极附近形成了氢氧化钠的溶液。电解饱和食盐水的总的化学方程式可以表示如下:
2NaCl+2H2O===电解====2NaOH+H2↑+Cl2↑
生成 氯气 氢气 氢氧化钠!溶液里有氢离子、氢氧根离子、氯离子、钠离子。电解开始水电离出的氢离子去负极放电生成氢气!由于氯离子的放电顺序先于氢氧根,所以在正极氯离子放电生成氯气,溶液里就只有氢氧根和钠离子了,正好就是氢氧化钠!
电解饱和食盐水总化学方程式?
电解饱和食盐水阳极氯离子失电子发生氧化反应生成氯气,阴极氢离子得到电子发生还原反应生成氢气,反应的化学方程式为2NaCl+2HO2NaOH+Cl↑+H↑,实验室制取氯气的反应物是二氧化锰和浓盐酸,产物是氯化锰和氯气、水,条件是加热,该反应中二氧化锰作氧化剂,浓盐酸是还原剂,实验室生产氯气的方程式为MnO+4HCl(浓)MnCl+Cl↑+2HO,答:电解饱和食盐水可生产氯气的方程式为2NaCl+2HO2NaOH+Cl↑+H↑;实验室生产氯气的方程式为MnO+4HCl(浓)MnCl+Cl↑+2HO.
电解饱和食盐水的原理是什么,为什么要加入稀氢氧化钠?
氯气的收集是在集气瓶中,用排饱和食盐水法或向上排空气法收集。最后通入NaOH溶液不是为了收集氯气,而是为了防止多余的氯气进入空气中,因为氯气是有毒的。也就是说,制取的氯气已经在集气瓶中了,通入NAOH中的那部分是多余的
电解饱和食盐水的原理是什么,——氯离子与氢离子在电极的作用下发生氧化还原反应,生成氯气与氢气。 为什么要加入稀氢氧化钠——主要 是为了增加导电性,加快电解的速度
我知道电解饱和食盐水呈碱性,我想知道刚开始溶液ph的形成过程以及电解后他的ph组成,氢和氢氧根分别谁?
饱和食盐水中本来就含有氢离子和氢氧根离子,呈中性。
电解时氢离子、钠离子移向负极,氢氧根离子、氯离子移向正极。由于氢离子比钠离子更容易得到电子形成游离态的氢气,所以负极留下的是钠离子;负极附近氯离子比氢氧根离子更容易失电子变成氯气,故最终电解留下的是氢氧根离子,水的PH值逐渐变大。所以电解饱和食盐水放出来的是氢气和氯气,在水中形成的是氢氧化钠到此,以上就是小编对于电解饱和食盐水的问题就介绍到这了,希望介绍关于电解饱和食盐水的5点解答对大家有用。
本文转载自互联网,如有侵权,联系删除